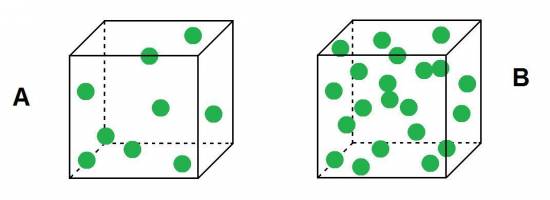
PRÁCTICA 15: Una unidad ficticia: el xol.
PRACTICA 15: UNA UNIDAD FICTICIA “EL XOL”
Nicole Joana Alba Arellano. 3BNicoleAlbaA01.blogspot.com
José Alberto Arciniega Soriano.
http://3bjosearciniegas3.blogspot.mx/
Vanessa Castañeda Ponce
http://3bkarlacastanedap04.blogspot.mx/
Iván Eduardo Chávez Gutiérrez.http://3bivanchavezg05.blogspot.mx/?m=1
Diana Itzel Contreras.
http://3bdianaitzelcontrerasg06.blogspot.mx/
Estefanía Guadalupe Contreras.
22/04/2016
OBJETIVO:
Trabajar con una unidad ficticia “xol” para medir la cantidad de las sustancias.
Hipótesis:
1.-Creemos que la masa será diferente para cada tipo de semillas.
2.-Pensamos que habrá pequeñas variaciones entre las semillas calculadas y las obtenidas porque no todas las semillas pesan lo mismo.
1.-Creemos que la masa será diferente para cada tipo de semillas.
2.-Pensamos que habrá pequeñas variaciones entre las semillas calculadas y las obtenidas porque no todas las semillas pesan lo mismo.
INVESTIGACIÓN:
Definición mol, su utilidad en Química.
¿Qué es un mol?, cuentan los expertos, refleja la cantidad de sustancia que posee un número específico de entidades de carácter elemental como átomos se pueden hallar en doce gramos de carbono-12. Esto quiere decir que el número de unidades elementales (como el caso de átomos, moléculas o iones, por ejemplo) que se reflejan en un mol de sustancia es una constante que no guarda relación directa con el tipo de partícula o del material en cuestión. Dicha cantidad se conoce con el nombre denúmero de Avogadro.
Esta constante, bautizada en homenaje al científico de origen italiano Amedeo Avogadro (1776–1856), permite contabilizar partículas microscópicas a partir de medidas macroscópicas (como es el caso de la masa).
Un personaje este, Conde de Quaregna y Cerreto, que además ejerció como profesor en la Universidad de Turín en el área de Física y que con dicha ley de Avogrado consiguió realizar una importante aportación a las ciencias. Básicamente con la misma lo que estableció fue que idénticos volúmenes de gases que se encuentran en las mismas condiciones, en lo que respecta a la temperatura y a la presión, contarán con el mismo número de partículas.
El número de Avogadro, por lo tanto, ayuda a que los expertos en Química expresen el peso de los átomos. La ecuación señala que un mol equivale a 6,022 x 10 elevado a 23 partículas. Se trata de una cifra inmensa capaz de reflejar una enorme cantidad de partículas.
Al expresar el total de átomos que se identifican en doce gramos de carbono-12, la masa en gramos de un mol de átomos de un elemento siempre coincide con el peso atómico en unidades de masa atómica del mismo elemento. Esto quiere decir que el número de Avogadro permite realizar conversiones entre el gramo y la unidad de masa atómica.
¿Qué es un mol?, cuentan los expertos, refleja la cantidad de sustancia que posee un número específico de entidades de carácter elemental como átomos se pueden hallar en doce gramos de carbono-12. Esto quiere decir que el número de unidades elementales (como el caso de átomos, moléculas o iones, por ejemplo) que se reflejan en un mol de sustancia es una constante que no guarda relación directa con el tipo de partícula o del material en cuestión. Dicha cantidad se conoce con el nombre denúmero de Avogadro.
Esta constante, bautizada en homenaje al científico de origen italiano Amedeo Avogadro (1776–1856), permite contabilizar partículas microscópicas a partir de medidas macroscópicas (como es el caso de la masa).
Un personaje este, Conde de Quaregna y Cerreto, que además ejerció como profesor en la Universidad de Turín en el área de Física y que con dicha ley de Avogrado consiguió realizar una importante aportación a las ciencias. Básicamente con la misma lo que estableció fue que idénticos volúmenes de gases que se encuentran en las mismas condiciones, en lo que respecta a la temperatura y a la presión, contarán con el mismo número de partículas.
El número de Avogadro, por lo tanto, ayuda a que los expertos en Química expresen el peso de los átomos. La ecuación señala que un mol equivale a 6,022 x 10 elevado a 23 partículas. Se trata de una cifra inmensa capaz de reflejar una enorme cantidad de partículas.
Al expresar el total de átomos que se identifican en doce gramos de carbono-12, la masa en gramos de un mol de átomos de un elemento siempre coincide con el peso atómico en unidades de masa atómica del mismo elemento. Esto quiere decir que el número de Avogadro permite realizar conversiones entre el gramo y la unidad de masa atómica.
http://definicion.de/mol/
¿Qué utilidad tiene el mol en la química?
La utilidad de este concepto de mol radica en que cuando consideramos reacciones químicas, las relaciones de masa de las sustancias reaccionantes quedan reducidas a números enteros que corresponden a la fórmula mínima.
En el laboratorio o en la industria no se trabaja con símbolos o números, se trabaja con sustancias concretas, que se palpan. Para facilitar las tareas de investigación sobre algún elemento químico los científicos utilizan siempre gran cantidad de átomos.
¿Qué utilidad tiene el mol en la química?
La utilidad de este concepto de mol radica en que cuando consideramos reacciones químicas, las relaciones de masa de las sustancias reaccionantes quedan reducidas a números enteros que corresponden a la fórmula mínima.
En el laboratorio o en la industria no se trabaja con símbolos o números, se trabaja con sustancias concretas, que se palpan. Para facilitar las tareas de investigación sobre algún elemento químico los científicos utilizan siempre gran cantidad de átomos.
https://es.wikibooks.org/wiki/Qu%C3%ADmica/Concepto_de_mol
MATERIAL:
- Balanza granataria.
- 4 platos desechables
- Calculadora.
SUSTANCIAS:
- 1 taza de frijol.
- 1 taza de maíz palomero.
- 1 taza de lentejas
- 1 taza de garbanzos.
PROCEDIMIENTO:
- Con la balanza midan la masa de 40 semillas de cada sustancia y regístrenlo en la siguiente tabla:
Semilla
|
Cantidad
|
Masa (g)
|
Frijol
| 40 semillas | 16.4g |
Maíz palomero
| 40 semillas | 6.5g |
Lenteja
| 40 semillas | 1.2g |
Garbanzo
| 40 semillas | 26.1g |
NOTA: esta unidad de 40 elementos equivale a 1 xol.
- Con ayuda de la balanza y sin contar las semillas pongan en cada uno de los platos desechables:
- 3.5 xoles de frijol
- 0.5 xoles de garbanzos
- 2 xoles de lentejas
- 5 xoles de maíz.
- Predigan cuántas semillas debe de haber de cada sustancia de acuerdo al número de xoles que midieron y regístrenlo.
- Ahora sí cuenten el número de semillas que obtuvieron de cada sustancia y registren los datos.
Semilla
|
No. de xoles
|
Masa (g)
|
Semillas calculadas
|
Semillas obtenidas experimentalmente
|
Frijol
| 3.5 | 57.4g | 140 | 147 |
Maíz palomero
| 5 | 32.5g | 200 | 227 |
Lenteja
| 2 | 2.4g | 80 | 71 |
Garbanzo
| 0.5 | 13.05g | 20 | 22 |
OBSERVACIONES (IMÁGENES Y DESCRIPCIÓN):
- Las lentejas pesan muy poco
- Los garbanzos pesan mucho
- En todos excepto en las lentejas se obtuvieron mas semillas
- En las lentejas se obtuvieron menos semillas de lo que esperabamos





ANÁLISIS:
- ¿Difiere el número de granos calculados con los obtenidos experimentalmente? ¿a que creen que se deba lo anterior? Si, creemos que se debe a que no todos las semillas son iguales y que ninguna pesa lo mismo.
- Predice el número de semillas o de xoles que habrá según sea el caso:
- 5.5 xoles de maíz=220 semillas
- 350 semillas de garbanzo=8.75 xoles
- 0.3 xoles de lentejas=12 semillas
- 9 semillas de frijol=0.225 xoles
- ¿Consideran que el xol es una forma indirecta de contar cosas pequeñas? ¿Por qué? Si porque se obtiene calculando y no experimentando directamente
CONCLUSIÓN:
En la practica de hoy creemos que cumplimos con el objetivo porque utilizamos correctamente el xol para medir las sustancias, también podemos concluir que el xol no es una unidad de medida 100% exacta porque había variaciones y pensamos que eso podría pasar con cualquier medida indirecta.